NOMENCLATURA AROMÁTICOS
PRESENTADO POR: CAMILA SILVA PAHUANA
PRESENTADO A: DIANA FERNANDA JARAMILLO
INSTITUCIÓN EDUCATIVA EXALUMNAS DE LA PRESENTACIÓN
IBAGUÉ - TOLIMA
2018
INTRODUCCIÓN
En este blog se brindara información acerca de la temática de hidrocarburos aromáticos en el área de química, entrando en un énfasis de ejercicios interactivos con su correspondiente teoría acerca de qué pasos se deben seguir para realizar los ejercicios, se espera que el lector de este blog le sirva de mucha ayuda para adquirir más conocimiento a su aprendizaje.
Los hidrocarburos aromáticos, son hidrocarburos cíclicos, llamados así al debido al fuerte aroma que caracteriza a la mayoría de ellos, se consideran compuestos derivados del benceno, pues la estructura cíclica del benceno se encuentra presente en todos los compuestos aromáticos.
Muchos compuestos aislados de fuentes naturales son parcialmente aromáticos. Además del benceno, benzaldehído y tolveno, otros compuestos complejos tienen anillos aromáticos, como la hormona esteroide femenina llamada estrona y el bien conocido analgésico de nombre morfina. Muchos fármacos sintéticos usados en medicina son también parcialmente aromáticos; el tranquilizante denominado diazepam (o valium) es uno de muchos ejemplos.
OBJETIVOS
- Identificar las características de los hidrocarburos aromáticos.
- Comprender la temática de aromáticos.
- Dar a conocer todo sobre los hidrocarburos aromáticos, qué son, su clasificación, cuál es su importancia, etc.
- Familiarizarse con la estructura química del Benceno.
- Dar a conocer el procedimiento adecuado para realizar los ejercicios.
MARCO TEÓRICO
HIDROCARBUROS AROMÁTICOS
Un hidrocarburo aromático o areno es un compuesto orgánico
cíclico conjugado que posee una mayor estabilidad debido a la deslocalización
electrónica en enlaces π.2 Para determinar esta característica se aplica la
regla de Hückel (debe tener un total de 4n+2 electrones π en el anillo) en
consideración de la topología de superposición de orbitales de los estados de
transición. Para que se dé la aromaticidad, deben cumplirse ciertas premisas,
por ejemplo que los dobles enlaces resonantes de la molécula estén conjugados y
que se den al menos dos formas resonantes equivalentes. La estabilidad
excepcional de estos compuestos y la explicación de la regla de Hückel han sido
explicados cuánticamente, mediante el modelo de "partícula en un
anillo".
Originalmente el término estaba restringido a un producto
del alquitrán mineral, el benceno, y a sus derivados, pero en la actualidad
incluye casi la mitad de todos los compuestos orgánicos; el resto son los
llamados compuestos alifáticos. El exponente emblemático de la familia de los
hidrocarburos aromáticos es el benceno (C6H6), pero existen otros ejemplos,
como la familia de anulenos, hidrocarburos monocíclicos totalmente conjugados
de fórmula general (CH)n.
La estructura del Benceno se caracteriza por:
- Es una estructura cerrada con forma hexagonal regular, pero sin alternancia entre los enlaces simples y los dobles (carbono-carbono).
- Sus seis átomos de carbono son equivalentes entre sí, pues son derivados mono sustituidos, lo que les hace ser idénticos.
- La longitud de enlace entre los carbonos vecinos ente sí son iguales en todos los casos. La distancia es de 139 pm, no coincidiendo con la longitud media de un doble enlace, que es de 133 pm, ni siquiera a la de un enlace simple, que es de 154 pm.
- Los átomos de carbono del benceno, poseen una hibridación sp2, en tres de los orbitales atómicos, y estos son usados para poder unirse a los dos átomos de carbono que se encuentren a su lado, y también a un átomo de hidrógeno.
- El orbital p (puro) de cada carbono restante, se encuentra orientado perpendicularmente al plano de anillo de hexágono, éste se solapa con los demás orbitales tipo p de los carbonos contiguos. Así, los seis electrones deslocalizados formarán lo que se conoce como, nube electrónica, que se colocará por encima, y también por debajo del plano del anillo.
ESTRUCTURA
Resonancia del Benceno. Cada carbono tiene tres electrones enlazados y el cuarto localizado gira alrededor del anillo.
Una característica de los hidrocarburos aromáticos como el
benceno, es la coplanaridad del anillo o la también llamada resonancia, debida
a la estructura electrónica de la molécula. Al dibujar el anillo del benceno se
le colocan tres enlaces dobles y tres enlaces simples. Dentro del anillo no
existen en realidad dobles enlaces conjugados resonantes, sino que la molécula
es una mezcla simultánea de todas las estructuras, que contribuyen por igual a
la estructura electrónica. En el benceno, por ejemplo, la distancia
interatómica C-C está entre la de un enlace σ (sigma) simple y la de uno π(pi)
(doble).
Todos los derivados del benceno, siempre que se mantenga
intacto el anillo, se consideran aromáticos. La aromaticidad puede incluso
extenderse a sistemas policíclicos, como el naftaleno, antraceno, fenantreno y
otros más complejos, incluso ciertos cationes y aniones, como el pentadienilo,
que poseen el número adecuado de electrones π y que además son capaces de crear
formas resonantes.
Estructuralmente, dentro del anillo los átomos de carbono
están unidos por un enlace sp2 entre ellos y con el orbital s del hidrógeno,
quedando un orbital p perpendicular al plano del anillo y que forma con el
resto de orbitales p de los otros átomos un enlace π por encima y por debajo
del anillo.
GRUPO ARILO
El grupo funcional arilo (símbolo: Ar) es el sustituyente
derivado de un hidrocarburo aromático al extraérsele un átomo de hidrógeno del
anillo aromático. El grupo arilo genérico sería el equivalente al grupo alquilo
genérico (R). El grupo fenilo (simbolizado Ph o φ) es el grupo arilo más
sencillo. Los hidrocarburos que no contienen anillos bencénicos se clasifican
como compuestos alifáticos.
Grupo fenilo enlazado a un grupo alquilo.
Químicamente son por regla general bastante inertes a la
sustitución electrófila y a la hidrogenación, reacciones que deben llevarse a
cabo con ayuda de catalizadores. Esta estabilidad es debida a la presencia de
orbitales degenerados (comparando estas moléculas con sus análogos alifáticos)
que conllevan una disminución general de la energía total de la molécula.
Sustitución electrofílica:
φ-H + HNO3 → φ-NO2 + H2O
φ-H + H2SO4
→ φ-SO3H + H2O
φ-H + Br2 +
Fe → φ-Br + HBr + Fe
Reacción Friedel-Crafts, otro tipo de sustitución
electrofílica:
φ-H + RCl + AlCl3 → φ-R + HCl + AlCl3
Otras reacciones de compuestos aromáticos incluyen
sustituciones de grupos fenilos.
APLICACIÓN
Entre los arenos más importantes se encuentran todas las
hormonas y vitaminas, excepto la vitamina C; prácticamente todos los
condimentos, perfumes y tintes orgánicos, tanto sintéticos como naturales; los
alcaloides que no son alicíclicos (ciertas bases alifáticas como la putrescina
a veces se clasifican incorrectamente como alcaloides), y sustancias como el
trinitrotolueno (TNT) y los gases lacrimógenos. Además ciertos analgésicos en
su estructura tienen al benceno como la aspirina, acetaminofeno e ibuprofeno.3
Por otra parte los hidrocarburos aromáticos suelen ser
nocivos para la salud, como los llamados BTEX, benceno, tolueno, etilbenceno y
xileno por estar implicados en numerosos tipos de cáncer o el alfa-benzopireno
que se encuentra en el humo del tabaco, extremadamente carcinógeno igualmente,
ya que puede producir cáncer de pulmón.
TOXICOLOGÍA
Los hidrocarburos aromáticos pueden ser cancerígenos. Se
clasifican como 2A o 2B.
El efecto principal de la exposición de larga duración (365
días o más) al benceno es en la sangre y los residuos fecales. El benceno
produce efectos nocivos en la médula de los huesos y puede causar una
disminución en el número de glóbulos rojos, lo que conduce a anemia. El benceno
también puede producir hemorragias y daño al sistema inmunitario, aumentando
así las posibilidades de contraer infecciones.
Algunas mujeres que respiraron altos niveles de benceno por
varios meses tuvieron menstruaciones irregulares y el tamaño de sus ovarios
disminuyó. Estudios en animales que respiraron benceno durante la preñez han
descrito bajo peso de nacimiento, retardo en la formación de hueso y daño en la
médula de los huesos. No se sabe si la exposición al benceno afecta al feto
durante el embarazo o a la fertilidad en los hombres.
En el organismo, el benceno es convertido en productos
llamados metabolitos. Ciertos metabolitos pueden medirse en la orina. Sin
embargo, este examen debe hacerse con prontitud después de la exposición y su
resultado no indica con confianza a cuánto benceno estuvo expuesto, ya que los
metabolitos en la orina pueden originarse de otras fuentes.
El benceno ha producido intoxicaciones agudas y crónicas en
su obtención y en sus múltiples aplicaciones en la industria química. A causa
de su elevada toxicidad, en cuantos casos es posible se sustituye por bencina y
otros solventes menos tóxicos.
El benceno actúa produciendo irritación local bastante
intensa, actúa como narcótico y tóxico nervioso. Su acción crónica se ejerce
especialmente como veneno hemático.
Ingerido por error ha producido gastritis. Se ha alcanzado
la muerte por ingestión de 30g del líquido.
Se ha determinado que el benceno es un reconocido
carcinógeno en seres humanos. La exposición de larga duración a altos niveles
de benceno en el aire puede producir leucemia. Cuando se produce la inhalación
de vapores concentrados, puede producir rápidamente la narcosis mortal, después
de un estado previo de euforia, embriaguez y convulsiones. La inhalación de
concentraciones más débiles origina torpeza cerebral, sensación de vértigo,
cefalea, náuseas, excitación con humor alegre, embriaguez que puede
transformarse en sueño, sacudidas musculares, relajación muscular, pérdida del
conocimiento y rigidez pupilar. En caso de intoxicación aguda, se produce
enrojecimiento de la cara y las mucosas.
NOMENCLATURAS
MONOSUSTITUIDOS
1. Se conocen muchos derivados de sustitución del benceno.
Cuando se trata de los compuestos monosustituidos, las posiciones en el anillo
bencénico son equivalentes. Los sustituyentes pueden ser: alquenilos, alquilos
, arilos.
2. Nombrar el sustituyente antes de la palabra benceno.
Nota: Algunos compuestos tienen nombres tradicionales
aceptados.
Formula del tolueno un compuesto monosustituido del benceno.
DISUSTITUIDOS
Cuando hay dos sustituyentes en el anillo bencénico sus
posiciones relativas se indican mediante números o prefijos, los prefijos
utilizados son orto-, meta- y para-, de acuerdo a la forma:
- orto- (o-): Se utilizan en carbonos adyacentes. Posiciones 1,2.
- meta- (m-): Se utiliza cuando la posición de los carbonos son alternados. Posiciones 1,3.
- para- (p-): Se utiliza cuando la posición de los sustituyentes están en carbonos opuestos. Posiciones 1,4.
Nombre de algunos compuestos disustituidos del benceno atendiendo su nomenclatura
POLISUSTITUIDOS
- Si hay más de dos grupos sustituyentes en el anillo benceno sus posiciones se deben indicar mediante el uso de números, la numeración del anillo debe ser de modo que los sustituyentes tengan el menor número de posición; cuando hay varios sustituyentes se nombran en orden alfabético.
- Cuando alguno de los sustituyentes genera un nuevo nombre con el anillo, este pasa a ser el nombre padre y se considera a dicho sustituyente en la posición uno (Ej: 1-amina-2-yodo benceno / 2-yodo anilina / orto-yodo anilina).
Nombre un compuesto polisustituido del benceno atendiendo su nomenclatura
BENCENO COMO RADICAL
- El anillo benceno como sustituyente se nombra fenilo.
- Cuando está unido a una cadena principal es un fenil.
AROMÁTICOS POLICÍCLICOS
- Para nombrar a este tipo de compuestos se indica el número de posición de los sustituyentes, seguido del nombre del sustituyente y seguido del nombre del compuesto.
- El orden de numeración de estos compuestos es estricta, no se puede alterar y por ende tienen nombres específicos
Nombre de un compuesto aromático policíclico atendiendo su nomenclatura.
OTROS
NAFTALINA
La naftalina (nombre no comercial: naftaleno; fórmula
química: C10H8) es un sólido blanco que se volatiliza fácilmente y se produce
naturalmente cuando se queman combustibles. También se llama alquitrán blanco y
se ha usado en bolas y escamas para ahuyentar las polillas. Quemar tabaco o
madera produce naftalina. Tiene un olor tan fuerte que puede resultar
desagradable. La 1-metilnaftalina y la 2-metilnaftalina son compuestos
similares a la naftalina. La 1-metilnaftalina es un líquido transparente y la
2-metilnaftalina es un sólido; ambos pueden olerse en el aire y en el agua en
concentraciones muy bajas.
ESTRUCTURA Y REACTIVIDAD
Una molécula de naftaleno se deriva de la fusión de un par
de anillos de benceno. (En la química orgánica, los anillos se funden, por dos
o más átomos comunes.) En consecuencia, naftaleno está clasificado como un
hidrocarburo aromático policíclico (HAP). Hay dos conjuntos de átomos de
hidrógeno equivalentes: el alfa de posiciones son las posiciones 1, 4, 5, y 8
en el dibujo a continuación, la versión beta y posiciones son las posiciones 2,
3, 6, y 7.
A diferencia de benceno, los enlaces de carbono-carbono en
el naftaleno no son de la misma longitud. Los enlaces C1-C2, C3, C4, C5 y
C6-C7-C8 se acerca 1,36 Å (136 pm) de longitud, mientras que el resto de los
bonos de carbono-carbono son aproximadamente 1,42 Å (142 pm) de largo. Esa
diferencia, que fue establecida por difracción de rayos-x, es coherente con los
enlaces de valencia modelados en la vinculación de naftaleno que comprende tres
estructuras de resonancia (como se muestra a continuación), mientras que los
enlaces de C1-C2, C3, C4, C5, C6 y C7 C8-dobles en dos de las tres estructuras,
los otros son el doble en sólo una.
Como el benceno, el naftaleno puede someterse a sustitución
electrofilica de aromáticos. Para muchas de estas reacciones, el naftaleno
reacciona bajo condiciones más leves que el benceno. Por ejemplo, mientras que
el benceno y el naftaleno reacciona con cloro en presencia de un cloruro
férrico o cloruro de aluminio catalizador, naftaleno y el cloro puede
reaccionar para formar 1-cloronaftaleno incluso sin un catalizador. Del mismo
modo, el benceno y el naftaleno puede ser alquilados utilizando reacciones de
Friedel-Crafts, el naftaleno también pueden ser alquilado por reacción con
alquenos o alcoholes, con el ácido sulfúrico o el ácido fosfórico como
catalizador.
La naftalina pasa de su estado sólido a gaseoso
inmediatamente, sin pasar por el estado líquido, en un proceso que se denomina
sublimación.
Puede saturarse totalmente por hidrogenación catalítica a
decalina. También puede reducirse parcialmente a tetralina o
1,4-dihidronaftaleno por reducción con sodio y etanol. La reducción de Birch
satura de una forma que se pierde la aromaticidad. La reducción de Benkeser es
un método de hidrogenación de hidrocarburos policíclicos aromáticos,
especialmente naftalenos, utilizándose litio o calcio metálico en presencia de
una amina primaria como agentes reductores.
La oxidación catalítica del naftaleno con dioxígeno y
pentóxido de vanadio forma el anhídrido ftálico, el cual por hidrólisis forma
el ácido ftálico. La ozonólisis del naftaleno produce aldehído ftálico.
USOS
El naftaleno (fórmula química: C10H8) tiene como uso
primordial la manufactura de plásticos de cloruro de polivinilo (PVC). Este
además, es utilizado como un intermediario químico o base para la síntesis de
compuestos ftálicos, antranílicos, hidrolixados, aminos y sulfónicos, los
cuales son utilizados en la manufacturación de distintos colorantes, resinas
sintéticas, negro de humo, pólvora sin humo y celuloides. El naftaleno se ha
empleado además como repelente de polillas y la 2-metilnaftalina se usa para
realización de vitamina K.
Hoy existe el mito de que la naftalina sirve para elevar los
octanos de la gasolina comercial, esto es parcialmente verdad, ya que los
compuestos son muy volátiles y tienden a mejorar el octanaje (RON, o MON). Pero
industrialmente no sería factible utilizar a la naftalina como un mejorador del
número de octano porque es un hidrocarburo aromático policíclico, y como tal,
un contaminante considerado peligroso. Por lo tanto se recurre a otros
mejoradores del número de octano.
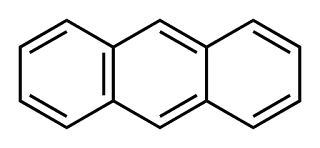
ANTRACENO
El antraceno es un hidrocarburo aromático policíclico. A
temperatura ambiente se trata de un sólido incoloro que sublima fácilmente. El
antraceno es incoloro pero muestra una coloración azul fluorescente cuando se
somete la radiación ultravioleta. En 2010 el Observatorio del Roque de los
Muchachos realizó unas mediciones en espectroscopia infrarroja de una región
situada a 700 años luz de la Tierra en la dirección de la estrella Cernis 52
(constelación de Perseo) y permitió la detección de ingentes cantidades de
antraceno suspendidas en una nube. Este descubrimiento aproxima el
entendimiento de como las moléculas prebióticas llegaron a la Tierra.
REACTIVIDAD
Aunque el antraceno es un sistema completamente aromático el
anillo central muestra también reactividad de dieno siendo susceptible de
reacciones Diels-Alder. El anillo central también es más fácilmente oxidable o
reducible, debido a la acción de los dos átomos centrales que conservan dos
anillos fenílicos con su sistema aromático intacto y por esta situación es
energéticamente más favorable.
APLICACIÓN
Casi todo el antraceno es oxidado
para dar antraquinona y por lo tanto sustancia de partida en la síntesis de una
amplia gama de colorantes como la alizarina. Además se utiliza en la síntesis
de algunos insecticidas, conservantes, etc. Un cristal de antraceno se utilizó
en el experimento de Chien Siung Wu para demostrar la violación de la paridad
en las interacciones débiles. En dicho experimento, un cristal de antraceno se
usó como detector de electrones, ya que al chocar estos con el cristal, emite
un destello, que con la ayuda de un fotomultiplicador permitió observar una
notable asimetría en la emisión de electrones, lo que permitió a su vez
demostrar la violación de la paridad.
FENANTRENO
El fenantreno es un hidrocarburo policíclico aromático
compuesto de tres anillos fusionados bencenos, como lo muestra la fórmula del
costado. Su formula empírica es C14H18
El nombre fenantreno es una composición de fenil y
antraceno. Provee el marco aromático de los esteroides. En su forma pura, es
encontrado en el humo del cigarrillo, y es un conocido irritante,
fotosensibilizando la piel a la luz.
QUÍMICA
Una clásica síntesis del fenantreno es la Síntesis
Bardhan-Sengupta del Fenantreno (1932). En la 2ª etapa de esta reacción
9,10-dihidrofenantreno es oxidada con selenio elemental.
Las reacciones del fenantreno ocurren en las posiciones 9 y
10. Algunas reacciones básicas:
- Oxidación inorgánica a fenantrenoquinona con ácido crómico
- Reducción orgánica a 9,10-dihidrofenantreno con gas hidrógeno y níquel
- Halogenación electrofílica a 9-bromofenantreno con bromuro
- Sulfonación aromática a 2 y 3-ácidos fenantrenesulfonicos con ácido sulfúrico
- Ozonólisis a difenilaldeído
FORMAS CANÓNICAS DEL FENANTRENO
Tiene cinco estructuras de resonancia, dos de las cuales
son:
¿COMO SE NOMBRAN?
Reciben este nombre
debido a los olores intensos, normalmente agradables, que presentan en su
mayoría. El nombre genérico de los hidrocarburos aromáticos mono y policíclicos
es "areno" y los radicales derivados de ellos se llaman radicales
"arilo". Todos ellos se pueden considerar derivados del benceno, que
es una molécula cíclica, de forma hexagonal y con un orden de enlace intermedio
entre un enlace sencillo y un doble enlace. Experimentalmente se comprueba que
los seis enlaces son equivalentes, de ahí que la molécula de benceno se
represente como una estructura resonante entre las dos fórmulas propuestas por
Kekulé, en 1865, según el siguiente esquema:
- Cuando el benceno lleva un radical se nombra primero dicho radical seguido de la palabra "-benceno".
clorobenceno, metilbenceno (tolueno) y nitrobenceno
- Si son dos los radicales se indica su posición relativa dentro del anillo bencénico mediante los números 1,2; 1,3 ó 1,4, teniendo el número 1 el sustituyente más importante. Sin embargo, en estos casos se sigue utilizando los prefijos "orto", "meta" y "para" para indicar esas mismas posiciones del segundo sustituyente.
1,2-dimetilbenceno, (o-dimetilbenceno) o (o-xileno)
1,3-dimetilbenceno, (m-dimetilbenceno) o (m-xileno)
1,4-dimetilbenceno, (p-dimetilbenceno) o (p-xileno)
- En el caso de haber más de dos sustituyentes, se numeran de forma que reciban los localizadores más bajos, y se ordenan por orden alfabético. En caso de que haya varias opciones decidirá el orden de preferencia alfabético de los radicales.
1-etil-2,5-dimetil-4-propilbenceno
- Cuando el benceno actúa como radical de otra cadena se utiliza con el nombre de "fenilo".
4-etil-1,6-difenil-2-metilhexano
SI NOS DAN LA FORMULA
Sitúa los
localizadores sobre los carbonos del benceno consiguiendo que los localizadores
de los radicales sean los más bajos posible. Ordena los radicales por orden
alfabético y luego escribe benceno.
SI NOS DAN EL NOMBRE
Coloca los localizadores sobre los carbonos del
benceno. Sitúa los radicales sobre los
carbonos correspondientes y completa la fórmula con los átomos de hidrógeno.
EJEMPLOS
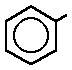 fenilo
fenilo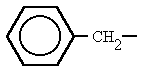 bencilo
bencilo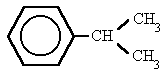 (cumeno)isopropilbenceno o (1-metiletil)benceno
(cumeno)isopropilbenceno o (1-metiletil)benceno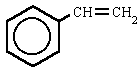 (estireno)etenilbenceno o vinilbenceno
(estireno)etenilbenceno o vinilbenceno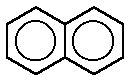 naftaleno
naftaleno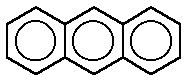 antraceno
antraceno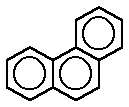 fenantreno
fenantreno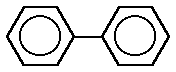 bifenilo
bifenilo
ACTIVIDAD INTERACTIVA
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
WEBGRAFÍA
http://www.alonsoformula.com/organica/aromaticos.htm
https://es.wikipedia.org/wiki/Fenantreno
https://es.wikipedia.org/wiki/Antraceno
https://es.wikipedia.org/wiki/Naftalina
https://es.wikipedia.org/wiki/Hidrocarburo_arom%C3%A1tico







































FUERA DE LA FECHA ACORDADA 2.0
ResponderBorrarCORRECCION FALTARON ALGUNOS EJERCICIOS E IMAGENES 4.0
ResponderBorrar